Ikatan ion merupakan ikatan yang terjadi
karena adanya gaya tarik menarik elektrostatis antara kation dan anion.
Contoh
pembentukan senyawa ion misalnya pembentukan senyawa natrium klorida atau yang
kita kenal dengan garam dapur. Proses pembentukan ion Na+ dan Cl- dapat dituliskan sebagai
berikut:
Na( 2 8 1) + Cl (2 8 7)
à Na+ Cl-
Lambang Lewis pembentukan senyawa Na+ Cl-
(sumber: google site) |
Atom natrium kehilangan satu elektron menjadi
bermuatan positif, sedangkan atom klor menjadi bermuatan negatif karena
kekurangan satu elektron. Pada pembentukan senyawa natrium klorida, kation Na+
bereaksi dengan anion Cl-. Karena kedua ion tersebut berlawan
muatan, maka diantara kedua ion tersebut terjadi gaya bakutarik elektrostatik
sehingga terbentuk senyawa NaCl. Susunan ion positif dan ion negatif sangat
rapat dan tidak mudah bergerak. Karena strukturnya yang teratur dan tersusun
rapi ini dalam kimia disebut stuktur kristalin.
Struktur kristalin senyawa NaCl (sumber: bospedia.com) |
Beberapa sifat ikatan ion berdasarkan struktur
senyawanya:
a.
Kristalnya Keras Tapi Rapuh
Kristal senyawa ion
bersifat keras karena strukturnya yang padat dan tersusun rapi antara ion
positif dan ion negatif. Namun, jika diberi tekanan pada kristalin tersebut maka
akan terjadi pergeseran yang mengakibatkan terjadinya reaksi tolak menolak
antara ion yang bermuatan sama dan menimbulkan perpecahan.
 |
Ilustrasi susunan ion-ion ikatan logam saat diberi tekanan (sumber: chemistryrack)
|
b.
Cenderung Mempunyai Titik Lebur dan Titik Didih yang Tinggi
Karena tarikan antar
ion kuat dan stabil sehingga diperlukan energi yang lebih besar untuk dapat
melelehkan padatan ionik.
c.
Mudah Larut Dalam Pelarut Polar
Pelarut polar tertarik
terhadap ion-ion. Bagian negatif pelarut polar tertarik ke ion positif sedangkan
bagian positifnya tertarik ke ion negatif.
 |
| Ilustrasi struktur senyawa ion dalam air (sumber: chemistryrack) |
d.
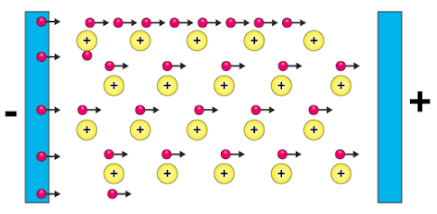
Lelehan dan Larutannya Dapat Menghantarkan Listrik.
Saat dilarutkan dengan
pelarut maka senyawa ion akan terionisasi, sehingga ion-ion positif dan ion-ion
negatif dapat bergerak bebas.
 |
| Ilustrasi senyawa ion yang dapat menghantarkan listrik (sumber:paperplane) |
Dalam kehidupan sehari-hari senyawa-senyawa
yang terbentuk melalui ikatan kimia memiliki manfaat yang luar biasa. Salah satu
contohnya yaitu natrium klorida (NaCl) atau
yang dikenal dengan nama garam dapur. Garam dapur biasanya berbentuk kristal
berwarna putih. Kegunaannya yaitu untuk penambah rasa makanan, bisa juga digunakan
untuk mengawetkan makanan.  |
| Gambar garam dapur (sumber:google site) |
Senyawa kalsium klorida (CaCl2) dalam
kehidupan sehari-hari biasanya digunakan pada air kolam renang yang biasa disebut
dengan kaporit. Penggunaan kalsium klorida ini bertujuan untuk mencegah korosif
yang akan menyebabkan kerusakan struktur logam pada kolam.  |
| Gambar bubuk kaporit (sumber: google.com) |
Natrium
florida (NaF) senyawa ini adalah senyawa yang mudah larut dalam air dan berbentuk
padat tidak berwarna. Dalam kehidupan sehari-hari, NaF sering ditambahkan ke
dalam air mineral dan pembuatan produk untuk menjaga kesehatan gigi. Manfat florida
sebagai ion dalam kehidupan kehidupan ini terkenal sebagai senyawa untuk
memperkuat gigi dengan membentuk fluorapatit yang merupakan komponen enamel
gigi.